Úvod
Termodynamika - rovnovážná a nerovnovážná
Klasická (rovnovážná) termodynamika se začala rozvíjet až po rozšíření parního stroje na začátku devatenáctého století. Je spjata
se slavnými jmény S. Carnota, W. Thomsona-lorda Kelvina, R. Clausia, J. P. Joula a H. Helmholtze, její statistická interpretace pak
se jmény J. W. Gibbse a L. Boltzmanna. Předmětem jejího zájmu se stal především popis izolovaných systémů, které po určitém čase dosáhnou rovnovážného stavu. Byla zavedena veličina entropie, která nabývá svého maxima právě dosažením rovnovážného stavu. Její změna je pak v tomto stavu nulová. Rovnovážná termodynamika poskytuje uspokojivé vysvětlení velkého množství fyzikálně - chemických jevů. Na rovnovážné struktury lze pohlížet jako na výsledek statistického vyrovnání chování mikroskopických prvků (molekul, atomů). Pokud se již jednou vytvořily, bez dalšího ovlivňování jejich okolím, existují tyto struktury libovolně dlouhou dobu.
Zkoumáme-li živé systémy, je situace zcela odlišná. Tyto systémy mohou existovat právě jen proto, že jsou otevřené. Spotřebovávají látku a energii z okolí. Krystal můžeme izolovat, ale buňky umírají, jsou-li od svého okolí trvale odděleny. Jinými slovy živé systémy vytvářejí nedílnou součást okolního světa, ze kterého čerpají potravu, a nemohou být odděleny od toků energie a látky, které
nepřetržitě přeměňují. To znamená, že využívají okolní energii na udržení (a případné zvýšení) své vlastní uspořádanosti.
Není to však jen živá příroda, která je modelům termodynamické rovnováhy vzdálená. Známe mnoho otevřených nebo uzavřených (dochází pouze k výměně energie) systémů z oblasti dynamiky tekutin či katalytických chemických reakcí. Proudící tekutina může
za určitých podmínek vytvářet prostorové a časové struktury. Koncentrace složek autokatalytických reakcí mohou oscilovat a ve spojení s difúzí vznikají prostorově uspořádané chemické vlny. Studiem těchto systémů se zabývá nerovnovážná termodynamika.
Její rozvoj je spojen především se jmény Larse Onsagera (1903-1976, na obr. vlevo) a Ilyi Prigogina (1917-2003, na obr. vpravo).


Nerovnovážnou termodynamiku obvykle dělíme na lineární a nelineární.
V lineární nerovnovážné termodynamice využíváme na základě principu lokální rovnováhy některé poznatky rovnovážné termodynamiky (systém můžeme nadále popisovat termodynamickými potenciály). Systém nespěje jako u rovnovážného systému k nulové produkci entropie, ale pouze k její minimální hodnotě, slučitelné s hraničními podmínkami systému. Tento ustálený stav se pak nazývá stacionární.
V nelineární nerovnovážné termodynamice jsou termodynamické síly působící na otevřený systém příliš veliké a systém ve stacionární stavu se stává nestabilní a vlivem fluktuací se od něj vzdaluje. Případný potenciál, který charakterizuje chování systému, musí mít vlastnosti Ljapunovovy funkce.
Nedílnou vlastností nerovnovážných systémů je vytváření makroskopických struktur, které nejsou jednoznačně odvoditelné z chování molekul tvořících systém. Tuto vlastnost mají nerovnovážné systémy díky tomu, že v nich může dojít k velkému zesílení náhodných, neměřitelných a nepředvídatelných poruch – fluktuací. Aby Prigogine odlišil výše zmíněné struktury od rovnovážných, nazval je disipativní, protože rozptylují (disipují) jimi protékající energii do okolí a zároveň se na úkor okolí také zbavují entropie. Zvyšují tedy entropii svého okolí (tomu odpovídá známá formulace I. Schrödingera: „Živé organizmy se živí zápornou entropií.“).
Základní pojmy
Makroskopický systém je část reality, uzavřená v objemu obsahující velký počet vzájemně interagujících částic (podsystémů), přičemž rozměry jednotlivých podsystémů jsou malé ve srovnání s objemem celého systému.
Realitu obklopující systém nazýváme okolí systému.
Termodynamický systém je makroskopický systém, ve kterém na sebe podsystémy působí převážně mechanickou a elektro-magnetickou interakcí.
Interakce systému s okolím:
Systém izolovaný nemůže vyměňovat se svým okolím ani energii, ani částice.
Systém uzavřený může se svým okolím vyměňovat energii, ne však částice.
Systém otevřený může docházet k výměně energie i částic s okolím.
Parametry systému jsou makroskopické veličiny, které charakterizují vlastnosti termodynamického systému a jeho vztah k okolí. Můžeme rozdělit na vnější a vnitřní a na globální a lokální.
Vnější parametry popisují působení okolí na systém. Řadíme mezi ně objem systému, počet jeho podsystémů nebo intenzitu elektrického či magnetického pole, které má zdroj mimo systém.
Vnitřní parametry systému popisují vlastnosti jeho podsystémů a jejich změny v důsledku v něm probíhajících procesů; jsou to např. koncentrace jednotlivých chemických komponent, tlaky, teploty atd.
Globální (extenzivní) parametry popisují systém jako celek a jsou aditivní. Aditivita v daném případě znamená, že rozdělíme-li systém na několik částí, je hodnota daného parametru pro celý systém rovna součtu všech jeho hodnot pro jednotlivé části. Globálními (extenzivními) parametry systému jsou např. jeho hmotnost, celková energie, nebo entropie.
Lokální (intenzivní) parametry systému závisí nejen na čase, nýbrž i na prostorových souřadnicích.
Stav termodynamického systému
- minimální soubor informací umožňující predikovat další chování systému. Stav systému shrnuje paměť systému a historii působení okolí na systém.
- množina hodnot nezávislých vnějších a vnitřních parametrů postačující k úplnému popisu systému.
Stavové parametry - parametry systému zvolené pro charakterizaci stavu.
Termodynamické funkce - charakterizují chování systému v závislosti na jeho vnějších a vnitřních parametrech.
Stavové funkce - termodynamické funkce, které závisí pouze na hodnotách parametrů v daném časovém okamžiku, jejich hodnota je charakteristická pro okamžitý stav systému. Obvykle se předpokládá, že okamžitý stav nezávisí na předchozích stavech, tj. na historii systému. Stavovou funkcí je např. vnitřní energie systému a další termodynamické potenciály.
Stavové rovnice - vymezují vzájemnou závislost jednotlivých parametrů systému. Příkladem jsou stavová rovnice ideálních plynů, nebo vztahy pro výpočet rychlostních konstant chemických reakcí nebo měrných tepel.
Mikrostav systému - soubor hodnot mikroskopických stavových parametrů.
Makrostav systému - stav systému, popsaný makroskopickými veličinami.
Stavový prostor - tvořený souřadnicemi, představujícími nezávislé stavové parametry, které určují makrostav systému. Každému stavu systému odpovídá ve stavovém prostoru bod, vývoj systému v čase je ve stavovém prostoru zobrazen křivkou - stavovou trajektorií.
Rovnovážný stav - nejpravděpodobnějšímu uspořádání systému, do kterého systém dospěje po určité konečné době, izolujeme-li jej od jeho okolí. Rovnovážný stav je plně popsán všemi nezávislými vnějšími parametry vyjadřující působení na systém a alespoň jedním parametrem vnitřním (např. teplotou). Všechny ostatní vnitřní parametry je potom možno odvodit ze znalosti vnějších parametrů a zvolených vnitřních parametrů pomocí stavových rovnic.
Relaxační doba - čas, za který se izolovaný termodynamický systém dospěje do rovnovážnému stavu. Závisí na charakteru mechanismů, které vedou systém k rovnováze, na rozměrech systému a počtu částic. Zatímco například vyrovnání koncentrace difúzí může trvat i několik let, vyrovnání rozdílu tlaku v plynu pouze zlomky sekundy.
Nerovnovážné stavy - stavy termodynamického systému mimo stav rovnováhy. Uzavřené a otevřené systémy se obvykle nacházejí
v nerovnovážných stavech v důsledku své neustálé interakce s vnějším prostředím.
Lokálně rovnovážný stav - systém je ve stavu lokální rovnováhy, pokud je možno jej rozdělit na velký počet disjunktivních podsystémů tak, aby každý podsystém byl opět termodynamickým systémem, a byl tak malý, že jeho stav je s dostatečnou přesností možno považovat za rovnovážný. Lze tedy říci, že příslušné podsystémy musí být tak velké, aby obsahovaly velký počet částic a na druhé straně tak malé, že intenzívní parametry podsystému se budou měnit pouze zanedbatelně. Hustoty extenzívních veličin systému se napříč těchto podsystémů musí měnit tak málo, aby bylo možno tyto změny zanedbat. Chování každého podsystému je potom možno popsat pomocí stavových rovnic odvozených pro rovnovážné systémy, ačkoliv systém jako celek není v rovnovážném stavu. Stavové rovnice odvozené pro dílčí podsystémy určují vztahy mezi intenzivními parametry a měřenými hodnotami extenzivních parametrů studovaného systému. Tento postup umožňuje využít ke studiu systémů mimo rovnovážný stav poznatky získané při studiu rovnovážných systémů.
Stacionární stav - tomto stavu jsou všechny parametry systému nezávislé na čase, tj. systém se s časem nemění. Na rozdíl
od rovnovážného stavu stacionární stav může nastat též u uzavřených a otevřených systémů v procesu výměny energie, případně částic s okolím.
Entropie v rovnovážných systémech
Zákon zachování energie čili první zákon termodynamiky umožňuje popsat energetickou bilanci v termodynamickém systému. To však nepostačuje k vyjádření všech jeho vlastností, především jeho časového vývoje. Při studiu nevratných procesů, jakými jsou například přechod tepla z tělesa teplejšího na chladnější nebo mísení látek, vyvstává potřeba zavést další veličiny, které by tyto procesy kvalitativně i kvantitativně popisovaly. Pro určení směru vývoje termodynamických procesů se zavádí veličina entropie, označovaná S. Entropie je termodynamický potenciál, tedy veličina, která v izolovaném systému nabývá svého maxima právě při dosažení rovnovážného stavu. Její další změna (produkce) je pak v tomto stavu nulová dS = 0. Entropie se zavádí tak, aby její změna
v izolovaném systému byla neustále kladná, dS > 0, což je formulace druhého termodynamického zákona pro izolované systémy. Dojde-li v termodynamickém systému k vymizení všech procesů přenosu energie a částic, dosahuje entropie svého maxima.
Při vratných procesech platí pro přírůstek entropie
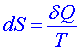 , (1)
, (1)
kde δQ je množství tepla dodané systému zvnějšku a T je termodynamická teplota.
Makroskopicky entropii interpretujeme jako měřítko nevratnosti procesu. Přestup tepla se děje vždy z tělesa teplejšího na chladnější,
a ne naopak.
K realizaci opačného procesu je třeba další energie, kdežto přímý proces probíhá samovolně. Jiným příkladem z oblasti chemických procesů je mísení. Každý tepelný, mechanický nebo chemický proces (případně jejich kombinace) přispívá svým dílem nevratnosti či ztrátovosti ke vzniku entropie. Obecně tedy entropie závisí na množství energie δQ dodané do systému zvnějšku a na změně jeho hmotnosti a vnitřního složení, které také může být doprovázeno změnou energie.
Entropie musí být stavovou funkcí vnitřních parametrů (vnitřní energie U, počet kilomolů chemické komponenty N) a vnějších parametrů (objem systému). Uvažujme nyní rovnovážné systémy, ve kterých probíhají pouze vratné procesy. Dosadíme-li za δQ z jedné z formulací prvního zákona termodynamiky:
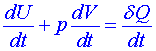 . (2)
. (2)
Připočteme-li množství tepla, kterým je doprovázena změna vnitřního složení (chemické reakce, fázové přechody), tj. 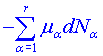 (3) dostáváme pro změnu entropie rovnici
(3) dostáváme pro změnu entropie rovnici
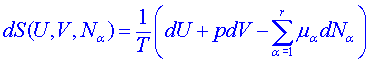 , (4)
, (4)
ve které T, p, μα jsou absolutní teplota, tlak a chemický potenciál α-té chemické komponenty. Rovnice (4) tedy vyjadřuje závislost změny entropie rovnovážného systému na změnách vnitřní energie U, objemu systému V a počtu kilomolů Nα jednotlivých chemických komponent.
Entropie v nerovnovážných systémech
Infinitezimální změnu entropie dS otevřeného systému můžeme vyjádřit jako součet:
![]() , (5)
, (5)
kde dinS představuje příspěvek k celkové změně entropie systému v důsledku vnitřních nevratných procesů (tzv. produkce entropie)
a dexS příspěvek k celkové změně entropie systému v důsledku toku entropie přes jeho hranice. Obecně lze potom formulovat druhý zákon termodynamiky následujícím způsobem: V libovolném podsystému daného systému je přírůstek probíhajících nevratných procesů kladný. Pomocí (5) lze druhý zákon termodynamiky pro vratné i nevratné procesy obecně vyjádřit ve tvaru
![]() , (6)
, (6)
kde znaménko rovnosti platí pouze pro vratné procesy.
Vraťme se zpět k zavedení entropie na počátku této kapitoly. Platí-li pro vratné procesy v rovnici(6) rovnítko, bude pro přítok entropie do systému platit
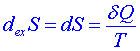 . (7)
. (7)
Dosadíme-li z této rovnice do (5), dostáváme vztah
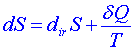 . (8)
. (8)
Entropii jsme dosud definovali pouze jako globální veličinu. Chceme-li se zabývat nerovnovážnými stavy systému, musíme však používat parametrů lokálních. Zavádíme proto měrnou hustotu entropie s :
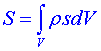 (9)
(9)
Nyní použijeme omezení pouze na systémy v lokálně rovnovážném stavu. Rozdělíme celý systém na soustavu myšlených podsystémů, které lze považovat za rovnovážné. Entropie rovnovážného podsystému není závislá na prostorových souřadnicích a je rovna měrné hustotě entropie s násobené hmotností podsystému. Totéž bude platit i pro měrnou hustotu vnitřní energie u a hmotnostní koncentraci cα. Protože se jedná o rovnovážné podsystémy, můžeme použít pro přírůstek entropie každého podsystému vztah (4), pro jednotkovou hmotnost dostáváme závislost mezi přírůstky měrných hodnot vnitřní energie u, entropie s, objemu v a hmotnostních koncentrací cα:
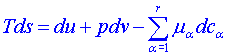 (10)
(10)
Tento vztah se nazývá Gibbsova rovnice. Lze ho chápat také jako definici hmotnostní hustoty entropie v systémech mimo rovnovážný stav. Platnost tohoto vztahu v sobě již obsahuje předpoklad platnosti principu lokální rovnováhy a je jeho bezprostředním důsledkem. Můžeme proto přistupovat k definici lokálně rovnovážného stavu obráceně a tvrdit, že systém je v lokálně rovnovážném stavu, pokud v něm platí Gibbsova rovnice (10), definující hmotnostní hustotu entropie tohoto systému.
Ireverzibilní procesy, probíhající v otevřeném termodynamickém systému, určují jeho časové chování. Protože ireverzibilita procesu je charakterizována změnami entropie, bude vhodné zde použít časovou změnu entropie systému jako celku. Bilanční rovnici entropie můžeme vyjádřit ve tvaru
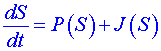 . (11)
. (11)
J(S) je tok entropie systémem. P(S) je produkce entropie vzniklá v důsledku ireverzibilních procesů v systému za jednotku času. Můžeme ji vyjádřit ve tvaru
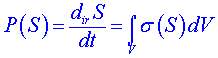 , (12)
, (12)
kde ![]() je hustota produkce entropie (tj. množství entropie vzniklé v jednotkovém objemu systému za jednotku času, obvykle
je hustota produkce entropie (tj. množství entropie vzniklé v jednotkovém objemu systému za jednotku času, obvykle ![]() nazýváme produkce entropie ve smyslu lokální produkce). Druhý termodynamický zákon vyjádřený ve tvaru (6) můžeme nyní formulovat lokálně ve tvaru
nazýváme produkce entropie ve smyslu lokální produkce). Druhý termodynamický zákon vyjádřený ve tvaru (6) můžeme nyní formulovat lokálně ve tvaru
![]() , (13)
, (13)
kde znaménko rovnosti platí pro vratné procesy.
Lokální produkce entropie ![]() je bilineární forma, ve které je každý člen představován součinem dvou veličin, zobecněného termodynamického toku Ji a zobecněné termodynamické síly Xi. Přitom síly Xi jsou příčinami vzniku zobecněných toků Ji. Termodynamické toky a síly pro různé děje jsou uvedeny v následující tabulce:
je bilineární forma, ve které je každý člen představován součinem dvou veličin, zobecněného termodynamického toku Ji a zobecněné termodynamické síly Xi. Přitom síly Xi jsou příčinami vzniku zobecněných toků Ji. Termodynamické toky a síly pro různé děje jsou uvedeny v následující tabulce:
Ireverzibilní proces |
Ji |
Xi |
Tenzorový charakter |
Vedení tepla |
Hustota tepelného toku jq |
|
vektor |
Difúze |
Hustota difúzního toku α-té komponenty jDα |
|
vektor |
Viskózní proudění |
Disipativní část tenzoru tlaku pdis |
|
tenzor druhého řádu |
Chemické reakce |
Rychlost α-té chemické reakce vα |
|
skalár |
V uvažovaném termodynamickém systému mohou k celkové produkci entropie přispívat nevratné procesy přenosu látky, tepla, hybnosti a též nevratné chemické reakce (viz tabulka). Vzhledem k tomu, že ![]() má podobnou strukturu pro všechny známé nevratné procesy, můžeme tento fakt považovat za nový postulát nerovnovážné termodynamiky, který můžeme formálně vyjádřit výrazem
má podobnou strukturu pro všechny známé nevratné procesy, můžeme tento fakt považovat za nový postulát nerovnovážné termodynamiky, který můžeme formálně vyjádřit výrazem
![]() , (14)
, (14)
kde sčítáme přes všechny ireverzibilní procesy přispívající k produkci entropie. Celkovou produkci entropie v systému dostaneme integrací výrazu (14) přes objem systému V
 (15)
(15)
V rovnovážném stavu platí v rovnici (13) rovnítko, dosadíme-li za produkci entropie ze vztahu (14), musí platit
![]() . (16)
. (16)
Podmínka (16) bude zřejmě splněna, pokud bude v rovnovážném stavu platit
![]() (17)
(17)
pro všechna i. Podmínka (17) tak vlastně definuje rovnovážný stav. Termodynamické síly Xi a toky Ji nejsou určeny jednoznačně, nýbrž jejich tvar závisí na konkrétním tvaru bilančních rovnic.
Zpracováno podle:
Duršpek J.: Moderní termodynamika v chemických a biologických procesech, Plzeň, 2005.
Dvořák I., Maršík I.: Biotermodynamika, Academia Praha 1998.
Maršík F.: Termodynamika kontinua, Academia, Praha 1999.
Prokšová J.: Entropie na středoškolské úrovni, MFF UK, Praha 2004.
Prigogine I., Kondepudi D.: Modern Thermodynamics, John Wiley & Sons, Chichester 1998.
Prigogine I.: Thermodynamic of Irreversible Processes, John Wiley and Sons, New York 1961
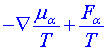 , Fα je vnější síla působící na α-tou chemickou komponentu, μα je chemický potenciál
, Fα je vnější síla působící na α-tou chemickou komponentu, μα je chemický potenciál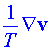 , v je unášivá rychlost
, v je unášivá rychlost