Nelineární nerovnovážná termodynamika
1. Základní charakteristika
Dosáhnou-li termodynamické síly, působící na otevřený systém, jisté mezní hodnoty, opouští systém stabilitu stacionárního stavu
a vlivem různých fluktuací se od něj vzdaluje. Označujeme ho jako systém vzdálený od rovnováhy nebo jako systém v silně nerovnovážném stavu. Vztahy, které existují mezi termodynamickými silami a toky u systémů vzdálených od rovnováhy, nejsou lineární a stabilita takových systémů již není důsledkem obecných fyzikálních zákonů.
Pokud se systém nachází daleko od rovnovážného stavu, roste prudce počet možných stavů, které může zaujmout. Takové systémy účinně disipují teplo a jsou navíc schopné vytvořit nový typ uspořádání závislý na existenci nerovnovážném stavu. Aby tyto struktury odlišil od rovnovážných struktur, nazval je I. Prigogine disipativní struktury.
V lineární termodynamice jsme charakterizovali vlastnosti stacionárních stavů teorémem minimální produkce entropie. Pro systémy vzdálené od rovnováhy podobné kritérium, které by určovalo jeho stav, není. Systém se však i v silně nerovnovážném stavu může vyvíjet směrem k nějakému stálému stavu, ale ten již obecně nemůžeme popsat vhodně vybraným potenciálem (jako tomu bylo
v lineární termodynamice, kdy tímto potenciálem byla produkce entropie). Způsob, jakým otevřený systém ve stacionárním stavu reaguje na fluktuace, ovlivňuje jeho další vývoj, který se může ubírat rozmanitým směrem – od nestability až k nově organizovaným strukturám.
2. Stabilita rovnovážného systému
Rozvineme entropii celé soustavy do Taylorovy řady kolem rovnovážného stavu ![]() :
:
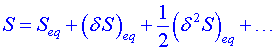 , (1)
, (1)
kde 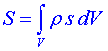 je celková entropie systému, který má objem V a je ohraničen plochou Ω. Znak δ zde označuje diferenciál, kterým je vyjádřena
je celková entropie systému, který má objem V a je ohraničen plochou Ω. Znak δ zde označuje diferenciál, kterým je vyjádřena
i malá fluktuace. Derivujeme vztah (1) podle času (časová změna entropie). Protože rovnovážný stav na čase nezávisí 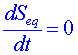 , dostaneme rovnici
, dostaneme rovnici
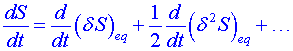 . (2)
. (2)
Odchylky od rovnovážné entropie ![]() spojíme s produkcí entropie v důsledku disipativních procesů. Časová derivace
spojíme s produkcí entropie v důsledku disipativních procesů. Časová derivace ![]() se potom rovná disipaci vyjádřené produkcí entropie, a tedy platí:
se potom rovná disipaci vyjádřené produkcí entropie, a tedy platí:
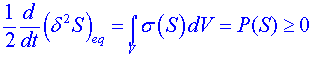 . (3)
. (3)
Provedeme-li integraci podmínky (3) podle času a předpokládáme-li, že splňuje nerovnost, dostáváme:
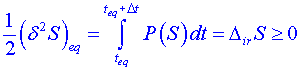 . (4)
. (4)
Z tohoto vztahu plyne následující interpretace druhého termodynamického zákona pomocí fluktuací. Odchylka od rovnovážného stavu (fluktuace) nemůže nerovnost (4) splňovat, protože entropie dosáhla svého maxima právě v rovnovážném stavu. Fluktuace v rovnovážném stavu entropii soustavy snižují, a platí proto obrácená nerovnost
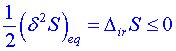 . (5)
. (5)
Vzhledem k tomu, že pro malé![]() platí přibližně
platí přibližně![]() a produkce entropie
a produkce entropie![]() , musí být
, musí být ![]() . Tudíž systém se fluktuací od rovnovážného stavu vrací do své minulosti. Podmínka (5) je nazývána zobecněnou podmínkou stability rovnovážného stavu.
. Tudíž systém se fluktuací od rovnovážného stavu vrací do své minulosti. Podmínka (5) je nazývána zobecněnou podmínkou stability rovnovážného stavu.
3. Vyšetřování stability stacionárního stavu podle Ljapunova
Základní myšlenkou této metody je vyšetřovat chování nějaké funkce![]() , přičemž proměnné
, přičemž proměnné ![]() mohou být např. koncentrace reakčních komponent, ale i jiné parametry systému. Funkce F musí mít určité vlastnosti, abychom podle jejího chování mohli usuzovat na stabilitu stacionárního bodu.
mohou být např. koncentrace reakčních komponent, ale i jiné parametry systému. Funkce F musí mít určité vlastnosti, abychom podle jejího chování mohli usuzovat na stabilitu stacionárního bodu.
Představme si, že za funkci F zvolíme vzdálenost bodu ![]() od stacionárního bodu
od stacionárního bodu ![]() , tedy
, tedy
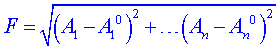 . (6)
. (6)
Pak při rostoucím čase se bod pohybuje po trajektorii a pokud tato je monotónní, pak se vzdálenost buď zvětšuje - bod se pohybuje
ze stacionárního bodu a stacionární bod je nestabilní - nebo se vzdálenost zmenšuje - bod míří do stacionárního bodu a řešení je stabilní. K rozhodnutí stačí znát znaménko derivace dF/dt. Jeli stále záporná, pak se vzdálenost s časem zmenšuje a bod míří
do stacionárního bodu.
Jestliže se podaří takovouto funkci F proměnných Aj nalézt, pak pro její totální diferenciál platí
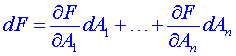 (7)
(7)
a po derivaci podle času dostaneme (použitím kinetických rovnic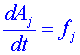 )
)
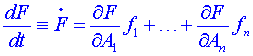 . (8)
. (8)
Na pravé straně rovnice (8) jsou funkce, které známe, a můžeme tedy vyšetřovat znaménko pravé strany v celé oblasti, aniž bychom potřebovali znát řešení Aj (t), takže soustavu diferenciálních rovnic není nutno integrovat. Je-li 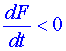 , pak řešení je stabilní. Funkce F se chová jako potenciál. I když obecný předpis pro konstrukci Ljapunovovy funkce neexistuje, často lze s úspěchem použít pro F kvadratickou formu.
, pak řešení je stabilní. Funkce F se chová jako potenciál. I když obecný předpis pro konstrukci Ljapunovovy funkce neexistuje, často lze s úspěchem použít pro F kvadratickou formu.
U systémů s pouze chemickými reakcemi má vlastnosti Ljapunovovy funkce výraz ![]() , neboť pro stacionární bod je
, neboť pro stacionární bod je![]() , jinde
, jinde ![]() a
a
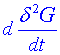 je vždy kromě stacionárního bodu záporná.
je vždy kromě stacionárního bodu záporná.
Poznámka: Volba funkce F jako vzdálenosti selže, jestliže trajektorie není monotónní, např. jestliže má tvar eliptické spirály. Pak
při přibližování bodu k ohnisku po spirále existují body ve vzdálenějších místech při delších časech a bližší body při kratších časech, jinak řečeno některý bod na závitu bližším ohnisku může být vzdálenější než jiný bod na vzdálenějším závitu. Proto je nutno volit funkci F účelněji, a to s požadavkem, aby v celém oboru byla kladná a jen pro stacionární bod nulová a aby její derivace podle času v celé oblasti byla záporná a ve stacionárním bodě nulová. Pro stanovení takové funkce v praxi neexistuje jednotný předpis, a každý případ je nutno řešit individuálně.
Další veličinou, která má vlastnosti Ljapunovovy funkce je ![]() , jak vyplývá z viz výše.
, jak vyplývá z viz výše.
4. Bifurkace
V předchozích odstavcích jsme řešili problematiku stability silně nerovnovážných systémů. Nyní se budeme zabývat procesy,
ke kterým dochází, pokud systém ztratí stabilitu. V rovnovážném stavu nebo v lineární oblasti stavu 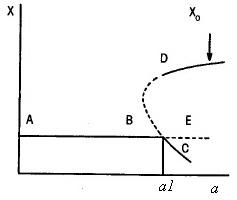 nerovnovážného je pouze jeden ustálený, stacionární stav, který je závislý na hodnotách určitých řídících parametrů. Řídicím parametrem, který označíme a, může být např. koncentrace určité látky. Zvětšuje-li se hodnota parametru a,systém se stále vzdaluje od stavu rovnováhy, až v určitém okamžiku dosáhne meze stability „termodynamické větve.“ Tím dosáhne bodu, který je zpravidla nazýván bifurkačním (větvícím) bodem.
nerovnovážného je pouze jeden ustálený, stacionární stav, který je závislý na hodnotách určitých řídících parametrů. Řídicím parametrem, který označíme a, může být např. koncentrace určité látky. Zvětšuje-li se hodnota parametru a,systém se stále vzdaluje od stavu rovnováhy, až v určitém okamžiku dosáhne meze stability „termodynamické větve.“ Tím dosáhne bodu, který je zpravidla nazýván bifurkačním (větvícím) bodem.
Bifurkační diagram na obrázku vpravo představuje stabilní stavy dané určitou koncentrací látky X, která je funkcí bifurkačního parametru a. Termodynamická větev B se v bifurkačním bodě vzhledem k fluktuacím stává nestabilní. Systém se při hodnotě a = a1 může nacházet ve třech odlišných stálých stavech na větvích C, Ea D. C a D jsou stabilní, E je nestabilní. Pro nízkou počáteční koncentraci látky X (oblast A) je průběh znázorněn větvemi B a C.
Bude-li naopak počáteční hodnota koncentrace X vysoká (X0 ) a hodnota parametru a bude udržována konstantní, je pravděpodobné, že se dostaneme do stavu na větvi D. Stav, kterého dosáhneme,
tedy závisí na předcházejícím vývoji systému. obr. 1
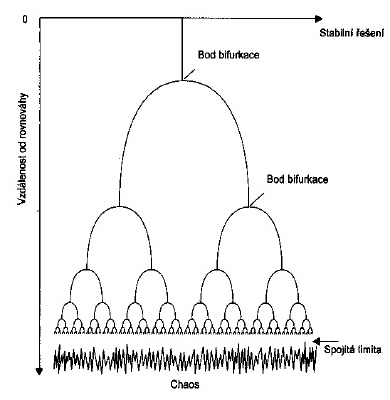
U složitějších systémů při vzdalování se od rovnováhy roste počet bifurkačních bodů, až se bifurkace objevují tak hustě, že vytváří téměř spojitý sled možných stavů. Nedokážeme předem určit do kterého stavu systém přejde, neboť nelze přesně určit výchozí podmínky. Chování systému se jeví chaotické. Měření zaznamenaná v jednom experimentu už nelze nikdy zopakovat, jde o citlivou závislost na výchozích podmínách. Jde o tzv. deterministický chaos (chování systému je předem determinováno výchozími podmínkami, na který je systém ve stavu nestability silně citlivý, pouze my je nemůžeme změřit s dostatečnou přesností) na rozdíl od stochastického chaosu způsobeného náhodnými fluktuacemi vnějšího prostředí. Na obrázku vlevo vidíme bifurkační kaskádu mířící k chaosu v nelineárním systému.
obr. 2
Zpracováno podle:
Duršpek J. : Moderní termodynamika v chemických a biologických procesech, Plzeň, 2005
Coveney P., Highfield R.: Mezi chaosem a řádem, Mladá fronta, Praha 2003.
Dvořák I., Maršík I..: Biotermodynamika, Academia Praha 1998.
Gleick J.: Chaos, Ando Publishing, Brno, 1996.
Maršík F.: Termodynamika kontinua, Academia, Praha 1999.
Prokšová J.: Entropie na středoškolské úrovni, MFF UK, Plzeň 2004.
Prigogine I., Kondepudi D.: Modern Thermodynamics, John Wiley & Sons, Chichester 1998.
Prigogine I.: Thermodynamic of Irreversible Processes, John Wiley and Sons, New York 1961.
Prigogine I., Stengers I.: Řád z chaosu, Mladá fronta, Praha 2001.
Tockstein A., Treindl L.: Chemické oscilace, Academia, Praha 1986.
Obrázky: obr.1: podle (Prigogine, Stengers, 2001), obr.2: (Coveney P., Highfield R., 2003)