Chemické vlny
 Vznik chemických vln
Vznik chemických vln
Vznik chemických vln můžeme pozorovat v tenké vrstvě reakčního média
pro Bělousovovu - Žabotinského reakci (například na Petriho misce).
Chemickou vlnou se rozumí šíření změny lokální koncentrace vrstvou reakčního systému.
Šíření takových vln chemické aktivity je jedním z výrazných příkladů samouspořádávání a vytváření struktury, které je podmíněno spojením procesu difúze s chemickou reakcí. Vlnové struktury se mohou šířit jak v oscilujícím, tak i v klidném excitovatelném prostředí. Tyto systémy se také označují jako chemicko-difúzní systémy.
obr. 1
Chemické vlny jsou případem tzv. autovln (AV resp. AW - autowave). Obecně lze říci, že AV jsou samoudržující se signály, které indukují procesy lokálního uvolňování energie v prostředí obsahujícím zdroje energie (tzv. aktivní prostředí). Uvolněná energie se spotřebovává při spouštění stejných procesů v sousedních oblastech.
Provedení
Použijeme následující reakční směs: 0,35 mol/l NaBrO3, 0,35 mol/l H2SO4, 0,14 mol/l CH2(COOH)2, 0,08 mol/l NaBr a 0,001 mol/l ferroinu. Před přídavkem ferroinu je třeba vyčkat, aby se uvolnil brom a tak se zabránilo vzniku sraženiny bromovaného
o-fenantrolinu. Homogenní roztok se vlije na Petriho misku tak, aby vytvořil slabou vrstvu.
Excitabilní prostředí
Zajímavé AV jevy probíhají v aktivních prostředích, ve kterých se obnovují vlastnosti prostředí po průchodu AV (tzv. refrakternost). Zde probíhají poměrně pomalé procesy, přeměňující prostředí z nízkoenergetického stavu (po projití AV) do výchozího vysoko - energetického stavu. Doba k tomuto procesu potřebná se nazývá refrakční doba. Tato prostředí se nazývají refrakterní nebo excitabilní.
K takovým refrakterním prostředím patří např. populace diferencujících se buněk (interagujících chemickými signály), sítnice oka, srdeční sval, ekologické systémy aj. Významnou charakteristikou je to, že principy chování všech aktivních prostředí (fyzikálních, chemických i biologických) jsou stejné a mohou být popsány způsobem nezávislým na konkrétním prostředí. V excitabilních prostředích mohou vznikat lokální samoudržující se zdroje autovln typu koncentrických vln, reverberátorů či spirálových vln.

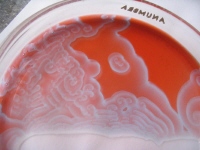
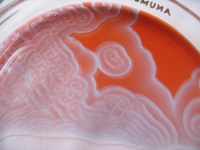
Koncentrické (cirkulární) vlny
Jestliže připravíme roztok pro BŽ reakci, vlijeme ho do Petriho misky a ponecháme v klidu, pozorujeme, že po určité době se začne objevovat skupina náhodně rozmístěných zdrojů,
z nichž se koncentricky šíří vlny. Tyto AV objevili Žabotinskij a Zajkin. Výhodou použití media BŽ reakce je, že vlnové obrazce mají makroskopické rozměry (přibližně několik milimetrů)
a jejich evoluce je dostatečně pomalá (s charakteristickou dobou kolem 1 minuty).
obr. 2
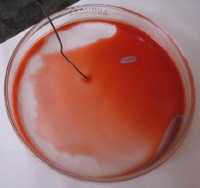 Vznik iniciačních center
Vznik iniciačních center
Koncentrické vlny se mohou generovat kdekoliv v reakční soustavě. Tato iniciační centra jsou způsobena buď heterogenitami (např. prachovými částicemi, plynovými bublinkami apod.), nebo vznikají v důsledku fluktuace koncentrací reagentů, které generují chemickou vlnu. Uměle je můžeme vyvolat napříkald pomocí stříbrného drátku (obr. vlevo), kdy dochází k oxidaci stříbra a redukci katalyzátoru. Vznik iniciačního centra v důsledku samovolné fluktuace je typický případ citlivé závislosti na výchozích podmínkách u nerovnovážných systémů.
obr. 3

obr. 4
Reverberátory
Reverberátory jsou dvouramenné spirální vlny, které vznikají v nehomogenních prostředích. V oblasti nehomogenity (tedy v oblasti s větší refrakteritou, nebo s překážkou) dochází k přerušení (přeryvu) postupující koncentrické vlny, ta se
zde nemůže šířit, a vznikají tak volné konce. Zatímco šíření souvislé reakční zóny probíhá jen ve směru z kruhu ven, šíření reakční zóny na volném konci vlny
probíhá nejen původním směrem, ale i ve směru podélném - volný konec má tendenci růst. Toto šíření reakce více směry má za následek stáčení volného konce do spirály, volný konec neustále roste a od něj se odvíjejí stále nové závity vlnové spirály. Mechanizmus vzniku volných konců je na následujícím obrázku.
obr. 5
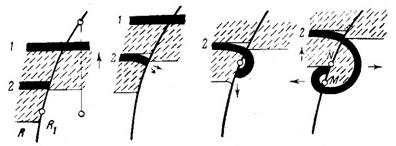
R značí oblast s menší refrakteritou, R1 je oblast s větší refrakteritou. Vlny 1 a 2 se šíří ve směru šipky na obr. směrem nahoru. Vlna 2 je díky více refrakterní oblasti přerušena a vzniká tak volný konec. Jak vlna postupuje směrem nahoru přejde vpravo delší refrakterní fáze. Volný konec se nyní může šířit nejen nahoru, ale i ve směru podélném tj. doprava. Tím dochází ke stočení volného konce do spirály.
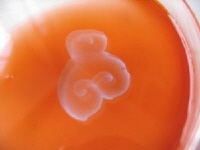
Ramena spirál se pak při určitém počtu závitů mohou periodicky setkávat. V tomto místě vlny anihilují tak, že vzniká následující obrazec: na obvodu vzniká nepřerušená (resp. znovu spojená) vlna, která se dále šíří podobně jako původní koncentrická vlna a uprostřed vzniká opět „nový“ reverbátor s volnými konci zatočenými do spirály, které dále rostou a při určitém počtu závitů se znovu setkají.
 Spirálové vlny
Spirálové vlny
Pokud vlna vzniká již v oblasti překážky, vytvoří se pouze jeden volný konec, který se dál spirálovitě šíří a vzniká tak tzv. spirálová vlna. Vzniklé spirály odpovídají podle tvaru nejčastěji Archimédovým spirálám, mohou však vznikat i spirály logaritmické.
obr. 6
Vývoj chemických vln

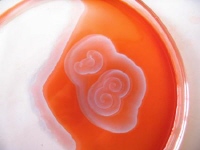




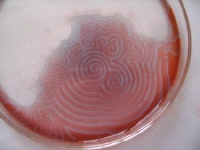
obr. 7
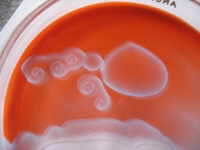
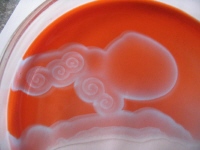
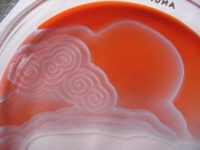




obr. 8
Kvantitativní popis
Systémy, v nichž probíhají jak chemické reakce, tak i difúzní procesy jsou popsány v případě dvousložkového systému
(např. Bruselátor) soustavou diferenciálních rovnic
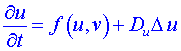 ,
, 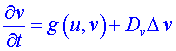
Zde u, v jsou koncentrace složek (reagentů), Du, Dv jsou součinitelé difúze složek u, v, nelineární výrazy f (u,v) a g (u,v) vyjadřují přírůstek (resp. úbytek) složek u a v jako důsledek chemické reakce. Předpokládá se, že v tomto systému každý bod (objemový element) reakčního prostoru koná či může konat autooscilace a že existuje difúzní spřažení mezi těmito body (objemovými elementy). Soustava popisuje nejen chemicko-difúzní procesy, ale i řadu jiných důležitých procesů, jako je např. šíření nervového vzruchu, mozkových vln, epidemií. Její použití pro vysvětlení chemických vln předpokládá, že koncentrace jsou spojitými funkcemi, že difúzní proces se řídí Fickovým zákonem a že členy f (u,v), g (u,v) lze odvodit z reakčního schématu.
Uvažujme nyní lineární reaktor délky L s osou ležící v ose x (přitom ![]() ), pak u = u (x, t ), v = v (x, t ) a předchozí soustavu zapíšeme jako:
), pak u = u (x, t ), v = v (x, t ) a předchozí soustavu zapíšeme jako:
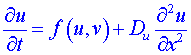 ,
, 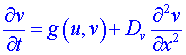
V nejjednodušším případě lze předpokládat, že veličiny Du a Dv jsou v celém reakčním prostoru konstantní.
Provedeme-li lineární analýzu stability prostorově homogenního stacionárního stavu tohoto systému vůči poruchám (odchylkám) koncentrací, obdržíme tyto závěry:
- Jestliže v systému neexistují difúzní procesy, tj. je-li Du = Dv = 0, je systém stabilní vůči uvažovaným poruchám.
- Systém je nestabilní vůči uvažovaným poruchám, jsou-li splněny následující podmínky:
- Hodnoty součinitelů difúze musí být nenulové a musí být u obou složek rozdílné, tj. Du ≠ Dv ≠ 0.
- Jedna z chemických reakcí musí být autokatalytická.
Zpracováno podle:
Duršpek J.: Moderní termodynamika v chemických a biologických procesech, Plzeň 2005.
Ivanickij G.R., Krinskij V.I.,Selkov E.E.: Matematičeskaja biofizika kletki, Nauka, Moskva 1978.
Krieger, J.: Oszillierende Chemische Reaktionen am Beispiel der Belousov-Zhabotinsky Reaktion, 2001
Ševčíková H.: Chemické vlny v laboratoři i v přírodě, Vesmír 75, 1996/3
Tockstein A., Treindl L.: Chemické oscilace, Academia, Praha 1986
Obrázky: obr. 4: (Ivanickij G.R.,1978) obr. 1- 3, 5- 8 foto autor