Chemické oscilační reakce
1. Bromičnanové oscilační reakce (Bělousovova - Žabotinského reakce)
Bělousovovu - Žabotinského (BŽ) reakci můžeme popsat jako oxidaci organické látky bromičnanem, která je katalyzována redoxním katalyzátorem, přičemž substrát reaguje s bromem za vzniku bromderivátu, který uvolňuje bromidové ionty při reakci
s oxidovanou formou katalyzátoru.
Různé uspořádání BŽ reakce:
Organické látky: organické kyseliny: malonová, citronová, jablečná, galová, oxaloctová; acetacetátester, 1,10 fenantriol, aceton, 2,4 pentandion,
2,5 hexandion.
Katalyzátory: ![]() /
/ ![]() (bezbarvá/žlutá),
(bezbarvá/žlutá),
![]() /
/ ![]() (bezbarvá/růžová),
(bezbarvá/růžová),
Ferroin![]() / Ferrin
/ Ferrin![]() (červená/modrá),
(červená/modrá),
![]() /
/![]() , bipyridin, 1,10 fenantriol.
, bipyridin, 1,10 fenantriol.
Mechanizmus BŽ reakce s ferroinem / ferrinem
V kroku I. je ferroin (Fe2+) oxidován bromičnanem a kyselinou bromitou (HBrO2) na ferriin(Fe3+), přičemž se autokatalyticky produkuje další kyselina bromitá Když je téměř všechen ferroin zoxidován na ferriin, rozběhne se druhý krok, opětovná redukce ferriinu na ferroin kyselinou brommalonovou (BrMA).
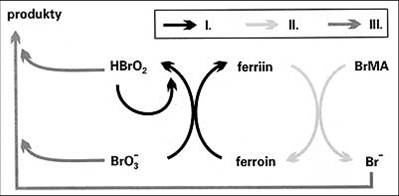 Bromid (Br-), vznikající v průběhu kroku II., působí jako inhibitor kroku I., neboť reaguje s bromičnanem i kyselinou bromitou (krok III.). Tím znemožňuje nastartování kroku I. do té doby, než je ukončen krok II. a všechen vzniklý bromid spotřebován v kroku III.
Pak je opět zahájen krok I. a celý cyklus se opakuje. Průběh reakce lze dobře pozorovat díky barevným změnám doprovázejícím oxidaci a redukci katalyzátoru (ferroin při nadbytku bromidu zbarvuje roztok červeně, ferriin při nadbytku bromičnanu modře).
Bromid (Br-), vznikající v průběhu kroku II., působí jako inhibitor kroku I., neboť reaguje s bromičnanem i kyselinou bromitou (krok III.). Tím znemožňuje nastartování kroku I. do té doby, než je ukončen krok II. a všechen vzniklý bromid spotřebován v kroku III.
Pak je opět zahájen krok I. a celý cyklus se opakuje. Průběh reakce lze dobře pozorovat díky barevným změnám doprovázejícím oxidaci a redukci katalyzátoru (ferroin při nadbytku bromidu zbarvuje roztok červeně, ferriin při nadbytku bromičnanu modře).
obr. 1
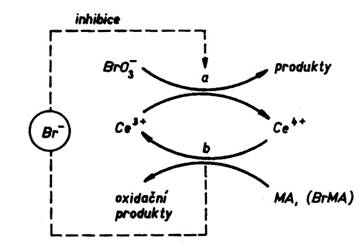
Kvantitativní popis BŽ reakce obr. 2
Nejpodrobněji je prozkoumána BŽ oscilační soustava ve složení: ![]() , kyselina malonová (MA), Ce3+ /Ce4+ v roztoku kyseliny sírové. Zjednodušený sled reakcí v BŽ systému lze vyznačit graficky schématem uvedeným na obr. vpravo, kde BrMA je kyselina brommalonová. Detailní mechanismus BŽ oscilační reakce navrhli Field, Körös a Noyes (tzv. F.K.N. mechanismus). Přesto, že zanedbává řadu interakcí meziproduktů, je ještě příliš složitý na to, aby se odpovídající soustava diferenciálních rovnic dala řešit analyticky. Na základě svého mechanismu formulovali Field a Noyes zjednodušený model, tzv. oregonátor.
, kyselina malonová (MA), Ce3+ /Ce4+ v roztoku kyseliny sírové. Zjednodušený sled reakcí v BŽ systému lze vyznačit graficky schématem uvedeným na obr. vpravo, kde BrMA je kyselina brommalonová. Detailní mechanismus BŽ oscilační reakce navrhli Field, Körös a Noyes (tzv. F.K.N. mechanismus). Přesto, že zanedbává řadu interakcí meziproduktů, je ještě příliš složitý na to, aby se odpovídající soustava diferenciálních rovnic dala řešit analyticky. Na základě svého mechanismu formulovali Field a Noyes zjednodušený model, tzv. oregonátor.
Detailní rozbor BŽ reakce (soubor Microsoft Word)
Teorie chemických oscilačních reakcí, oregonátor (soubor Microsoft Word)
Provedení a demonstrace BŽ reakce s Mn2+ ionty jako katalyzátorem
- video (4,9 MB, zkomprimováno v DivXPro(tm) 5.1.1 Codec, instalační program zde)
Použité chemikálie: malonová kyselina, bromičnan draselný, síran manganatý, konc. kyselina sírová.
Postup: Ve 200 ml destilované vody bylo rozpuštěno 20 ml konc. kyseliny sírové, 2,2 g kyseliny malonové(MA), 2 g bromičnanu draselného a 2 g síranu manganatého. Směs stále mícháme na magnetické míchačce při pokojové teplotě. Perioda mezi zabarvením a odbarvením byla 50 s.



 obr. 3
obr. 3
BŽ reakce s katalytickými systémy Ce3+/Ce4+, Ferroin(Fe2+)/Ferrin(Fe3+)
- video (9,8 MB, zkomprimováno v DivXPro(tm) 5.1.1 Codec, instalační program zde)
Použité chemikálie: bromičnan draselný, destilovaná voda, malonová kyselina (MA), bromid draselný, síran ceričitý, kyselina sírová, síran železnatý, 1,10-fenantrolin.
Postup: Byly připraveny roztoky:
A - 9,5 g bromičnanu draselného ve 250 ml vody
B - 8 g malonové kyseliny a 1,75 g bromidu draselného ve 250 ml vody
C - 0,8 g síranu ceričitého, 40 ml konc. kyseliny sírové a doplněno na 250 ml vody
D - indikátor 0,56g 1,10-fenantrolinu s 0,23 g síranu železnatého ve 100 ml vody
V 1 litrové kádince na magnetické míchačce byly smíchány roztoky A,B,C objemů 250 ml a přidáno 30 ml roztoku D. Dochází ke střídání zelené, modré a červenofialové složky. Perioda se během pokusu mírně mění, což můžeme chápat jako projev deterministicky chaotického chování.




 obr. 4
obr. 4
2. Vnější vlivy na BŽ reakci
Vliv mechanického míchání na BŽ reakci
Vliv mechanického míchání na BŽ reakci se dosud vysvětluje různě. Podle některých autorů intenzita míchání ovlivňuje oscilační chování BŽ reakce
s mnoha organickými substráty. Oscilace se zmenšují, neboť míchání ovlivňuje disipativní struktury a narušuje „organizaci“ v čase i prostoru. Oscilace také mohou zanikat při jisté kritické rychlosti míchání jako důsledek turbulence. Také je možné, že efekt mechanického míchání spočívá ve vlivu vzdušného kyslíku a nesouvisí se změnou disipativní struktury nebo s turbulencí. Oba dva tyto faktory ovlivňují počet oscilací i délku indukční periody.
Vliv kyslíku na BŽ reakci
Kyslík prodlužuje indukční periodu a periodu oscilací, zkracuje celkový čas trvání oscilací. Při vyšších hodnotách poměru koncentrací katalyzátoru a substrátu zkracuje kyslík indukční periodu a zdánlivá aktivační energie periody první oscilace klesá. Vliv kyslíku na BŽ reakci závisí na počáteční koncentraci substrátu. Při nízké koncentraci kyseliny malonové (MA) změní kyslík stabilní stacionární stav na oscilační. Naopak při vyšší koncentraci MA inhibuje kyslík oscilace, přičemž stacionární stav je excitabilní. Zastavením přívodu kyslíku se oscilace obnoví. Inhibice oscilací neznamená inhibici oxidační reakce.
Citlivost na kyslík závisí na typu katalyzátoru, klesá v řadě ![]() ,
, ![]() ,
, ![]() . V průběhu BŽ reakce se kyslík spotřebovává a tím se mění i stechiometrie výsledné látkové přeměny při konstantním sycení BŽ soustavy kyslíkem dochází ke koncentračním oscilacím rozpuštěného kyslíku. Při probublávání BŽ soustavy kyslíkem jsou možné dva typy koncentračních oscilací rozpuštěného kyslíku, a to buď v oblasti nízkých, nebo vysokých koncentrací. Druhý typ je podmíněn vynášením bromu z reakční soustavy. Kromě toho bylo pozorováno, že objemové elementy roztoku nedostatečně sycené kyslíkem mohou být zdrojem oscilací pro celý reakční objem. Popsané oscilace kyslíku ještě více zdůvodňují úsilí modelovat i složité biochemické a biologické oscilátory na základě BŽ reakce.
. V průběhu BŽ reakce se kyslík spotřebovává a tím se mění i stechiometrie výsledné látkové přeměny při konstantním sycení BŽ soustavy kyslíkem dochází ke koncentračním oscilacím rozpuštěného kyslíku. Při probublávání BŽ soustavy kyslíkem jsou možné dva typy koncentračních oscilací rozpuštěného kyslíku, a to buď v oblasti nízkých, nebo vysokých koncentrací. Druhý typ je podmíněn vynášením bromu z reakční soustavy. Kromě toho bylo pozorováno, že objemové elementy roztoku nedostatečně sycené kyslíkem mohou být zdrojem oscilací pro celý reakční objem. Popsané oscilace kyslíku ještě více zdůvodňují úsilí modelovat i složité biochemické a biologické oscilátory na základě BŽ reakce.
Excitabilita BŽ reakce
Pozoruhodnou vlastností BŽ soustavy je její excitabilita za vhodných podmínek. Tak bylo pozorováno, že se BŽ soustava po skončení oscilačního režimu excituje k novým oscilacím přídavkem iontů ![]() nebo zastavením mechanického míchání. U BŽ soustavy s přítomností
nebo zastavením mechanického míchání. U BŽ soustavy s přítomností ![]() ,
, ![]() nebo
nebo ![]() byly popsány oscilační chemiluminiscence a fotoluminiscence.
byly popsány oscilační chemiluminiscence a fotoluminiscence.
3. Jodičnanové oscilační reakce
Bray v r. 1921 zjistil, že při reakci jodičnanu s peroxidem vodíku v prostředí kyseliny sírové dochází k vývoji kyslíku rychlostí, která se periodicky mění za současných oscilací koncentrace jodu. Později tuto reakci podrobně studoval Liebhafsky, takže dnes je v literatuře uváděna pod názvem Brayova-Liebhafského reakce.
Rovněž byly studovány jodičnanové oscilátory, v nichž peroxid vodíku byl doplněn cysteinem nebo nahrazen arzenitanem či kyselinou mandlovou (eventuálně za spoluúčasti iontů ![]() ), popřípadě doplněn ionty
), popřípadě doplněn ionty ![]() spolu s kyselinou malonovou.
spolu s kyselinou malonovou.
Zvláště poslední případ byl podrobně experimentálně studován pod názvem Briggsova - Rauscherova reakce. Bylo zjištěno, že kterákoliv dvojice z reakčních složek ![]() ,
, ![]() ,
, ![]() ; buď viditelně nereaguje, nebo reaguje velice pomalu, jsou-li přítomny však všechny tři komponenty (
; buď viditelně nereaguje, nebo reaguje velice pomalu, jsou-li přítomny však všechny tři komponenty (![]() stačí ve velmi malé koncentraci), je rychlost oxidace
stačí ve velmi malé koncentraci), je rychlost oxidace ![]() jodičnanem až tisíckrát větší, oscilační průběh však nenastává. Přidá-li se k této směsi kyselina malonová, objeví se velmi zřetelné oscilace koncentrací
jodičnanem až tisíckrát větší, oscilační průběh však nenastává. Přidá-li se k této směsi kyselina malonová, objeví se velmi zřetelné oscilace koncentrací ![]() ,
,![]() (a dalších látek).
(a dalších látek).
Provedení a demonstrace Briggsovy - Rauscherovy reakce
- video (3,6 MB, zkomprimováno v DivXPro(tm) 5.1.1 Codec, instalační program zde)
Použité chemikálie: jodičnan draselný, kyselina sírová, malonová kyselina, síran manganatý, peroxid vodíku, roztok škrobu.
Postup: Byly připraveny roztoky:
A - 1,7 g jodičnanu draselného a 10 ml 1 M kyseliny sírové bylo rozpuštěno ve 100 ml destil. vody.
B - 1 g malonové kyseliny, 1,5 g síranu manganatého a 10 ml roztoku škrobu bylo rozpuštěno ve 100 ml destil. vody
C - 135 ml 10 % roztoku peroxidu vodíku
Po slití roztoků A,B a C a stálém míchání na magnetické míchačce se střídavě objevovalo modré zabarvení s periodou 10 s.




 obr. 5
obr. 5
4. Jiné oscilační reakce
Bromičnanovým a jodičnanovým oscilátorům by měl odpovídat chlorečnanový oscilátor. Ten však nebyl nalezen. Zato se podařilo objevit v průtočném ideálně míchaném reaktoru chloritanové oscilátory. Jako první oscilátor tohoto typu byl nalezen systém ![]() ,
, ![]() ,
, ![]() . V dalších studiích se podařilo nahradit arzenitan jinými redukovadly (
. V dalších studiích se podařilo nahradit arzenitan jinými redukovadly (![]() , kys. askorbová,
, kys. askorbová, ![]() ). Dále byl nalezen systém bez jodičnanů, kde redukovanou formou je buď thiosíran, nebo jodidový ion. Tento oscilátor
). Dále byl nalezen systém bez jodičnanů, kde redukovanou formou je buď thiosíran, nebo jodidový ion. Tento oscilátor ![]() ,
, ![]() je považován za nejjednodušší prototyp chloritanového oscilátoru vůbec. Další obměny tohoto základního oscilátoru spočívají pak v tom, že do systému je přiváděna další oxidovaná forma(
je považován za nejjednodušší prototyp chloritanového oscilátoru vůbec. Další obměny tohoto základního oscilátoru spočívají pak v tom, že do systému je přiváděna další oxidovaná forma(![]() ,
,![]() ,
, ![]() ,
, ![]() ).
).
První nehalogenový oscilátor byl popsán v r. 1965 Rinkerem a spolupracovníky, kteří nalezli při tepelném disproporcionačním rozkladu dithioničitanu podle reakce:
![]()
Nejprve indukční periodu a po ní pokles koncentrace iontů ![]() , který probíhal oscilačním způsobem. Pokud nebyly roztoky pufrovány, objevily se i oscilace koncentrace vodíkových iontů. Chemické oscilace po čase zanikají, pokud nejsou udržované v průtokovém systému přítokem reaktantů a odběrem produktů. Nitzan a Ross ukázali, že trvalé oscilace mohou rovněž probíhat tehdy, když je systém „napájen“ tokem energie, např. kontinuálním osvětlením.V tomto případě se používá kontinuální osvětlení na vyvolání fotochemické reakce v roztoku a nevratná spotřeba reaktantů je přitom provázena časovými oscilacemi emitovaného nebo absorbovaného záření. Světlo je současně stimulem i sondou takovýchto oscilačních reakcí, a proto se tyto soustavy nazývají fotochemicky řízené oscilátory anebo jednodušeji fotochemické oscilátory. Micheau se spolupracovníky dokázali, že kinetická analýza bifotonických procesů vede k multistacionárním stavům a k oscilacím. Bifotonické procesy, jejichž rychlost je přímo úměrná druhé mocnině intenzity světla, jsou aktuální při fotosyntéze, při konstrukci solárních článků atd. K nejstarším oscilačním chemickým reakcím patří termochemické oscilace v některých plynných reakcích. Oxidace plynných uhlovodíků jsou často provázeny perio-dickými pulsy světla emitovaného po dobu opakovaných nárůstů zvýšené reaktivity. Oscilace v elektrochemických soustavách jsou známy již dávno. Pro vysvětlení elektrochemických oscilací je kinetické hledisko důležitější než termodynamické, zvláště pokud jde o pochopení jejich molekulového mechanismu. V souvislosti s oxidačními a redukčními procesy na elektrodách byl pozorován kvalitativně odlišný typ oscilací. Mezi elektrochemické oscilace patří též elektroosmotické oscilace na buněčných membránách.
, který probíhal oscilačním způsobem. Pokud nebyly roztoky pufrovány, objevily se i oscilace koncentrace vodíkových iontů. Chemické oscilace po čase zanikají, pokud nejsou udržované v průtokovém systému přítokem reaktantů a odběrem produktů. Nitzan a Ross ukázali, že trvalé oscilace mohou rovněž probíhat tehdy, když je systém „napájen“ tokem energie, např. kontinuálním osvětlením.V tomto případě se používá kontinuální osvětlení na vyvolání fotochemické reakce v roztoku a nevratná spotřeba reaktantů je přitom provázena časovými oscilacemi emitovaného nebo absorbovaného záření. Světlo je současně stimulem i sondou takovýchto oscilačních reakcí, a proto se tyto soustavy nazývají fotochemicky řízené oscilátory anebo jednodušeji fotochemické oscilátory. Micheau se spolupracovníky dokázali, že kinetická analýza bifotonických procesů vede k multistacionárním stavům a k oscilacím. Bifotonické procesy, jejichž rychlost je přímo úměrná druhé mocnině intenzity světla, jsou aktuální při fotosyntéze, při konstrukci solárních článků atd. K nejstarším oscilačním chemickým reakcím patří termochemické oscilace v některých plynných reakcích. Oxidace plynných uhlovodíků jsou často provázeny perio-dickými pulsy světla emitovaného po dobu opakovaných nárůstů zvýšené reaktivity. Oscilace v elektrochemických soustavách jsou známy již dávno. Pro vysvětlení elektrochemických oscilací je kinetické hledisko důležitější než termodynamické, zvláště pokud jde o pochopení jejich molekulového mechanismu. V souvislosti s oxidačními a redukčními procesy na elektrodách byl pozorován kvalitativně odlišný typ oscilací. Mezi elektrochemické oscilace patří též elektroosmotické oscilace na buněčných membránách.
5. Metody hledání nových chemických oscilátorů
Se systematickým hledáním nových chemických oscilátorů se začalo až začátkem osmdesátých let dvacátého století, kdy De Kepper, Epstein a Kustin použili kontinuálně míchaný průtokový reaktor jako nástroj objevování nových oscilačních soustav. Na univerzitě v Brandeis (USA) se zformovala výzkumná skupina (Američani Epstein a Kustin, De Kepper z Francie a Orbán z Maďarska), která experimentálně ověřila předpoklady Boissonada a De Keppera a popsala prvý chemický oscilátor nalezený tímto způsobem.
Již předtím Boissonade a De Kepper vyšetřovali vztah mezi bistabilitou stacionárního stavu a oscilacemi. Při teoretickém studiu poměrně jednoduchého systému vykazujícího bistabilitu zjistili, že zavede-li se do něj zpětná vazba, může bistabilita zaniknout a při vhodné hodnotě parametrů systému se mohou objevit oscilace.
Hledání nových chemických oscilátorů vyžaduje testovat velké množství reakčních směsí, které se nacházejí v dostatečné vzdálenosti od rovnováhy. Na zabezpečení této podmínky je vhodné použít shora uvedený průtokový reaktor. Proměnné veličiny, tzv. externí parametry, které může měnit experimentátor, jsou: složení roztoků v zásobnících, rychlost přítoku a teplota.
Podmínky pro vznik oscilací chemického systému jsou:
- Dostatečná vzdálenost od rovnováhy, realizovatelná průtočným reaktorem. Existence autokatalytické látky a zpětnovazebné látky reagující s předchozí látkou (pozitivní a negativní zpětná vazba).
- Existence násobných stacionárních stavů. Systémy s vícenásobnými stacionárními stavy vykazují hysterezi a změnou některého externího parametru je možno někdy destabilizovat stacionární stav, a tak generovat oscilace.
Zpracováno podle:
Duršpek J.: Moderní termodynamika v chemických a biologických procesech, Plzeň 2005.
Krieger, J.: Oszillierende Chemische Reaktionen am Beispiel der Belousov-Zhabotinsky Reaktion, 2001
Prigogine I., Kondepudi D.: Modern Thermodynamics, John Wiley & Sons, Chichester 1998.
Ševčíková H.: Chemické vlny v laboratoři i v přírodě, Vesmír 75, 1996/3
Tockstein A., Treindl L.: Chemické oscilace, Academia, Praha 1986
Obrázky: obr.1:(Ševčíková H.,1996) obr.2:(Tockstein A., Treindl L.,1986) obr. 3-5 foto autor